
Semua konten iLive ditinjau secara medis atau diperiksa fakta untuk memastikan akurasi faktual sebanyak mungkin.
Kami memiliki panduan sumber yang ketat dan hanya menautkan ke situs media terkemuka, lembaga penelitian akademik, dan, jika mungkin, studi yang ditinjau secara medis oleh rekan sejawat. Perhatikan bahwa angka dalam tanda kurung ([1], [2], dll.) Adalah tautan yang dapat diklik untuk studi ini.
Jika Anda merasa salah satu konten kami tidak akurat, ketinggalan zaman, atau dipertanyakan, pilih dan tekan Ctrl + Enter.
Patogenesis hepatitis B
Ahli medis artikel
Terakhir ditinjau: 07.07.2025
Dalam patogenesis hepatitis B, beberapa mata rantai utama dalam rantai patogenesis dapat diidentifikasi:
- pengenalan patogen - infeksi;
- fiksasi pada hepatosit dan penetrasi ke dalam sel;
- perkembangbiakan virus dan “pendorongannya” ke permukaan hepatosit, serta ke dalam darah;
- aktivasi reaksi imunologi yang bertujuan untuk menghilangkan patogen;
- kerusakan kompleks imun pada organ dan sistem;
- pembentukan kekebalan, pelepasan patogen, pemulihan.
Karena infeksi hepatitis B selalu terjadi secara parenteral, dapat dianggap bahwa saat infeksi secara praktis setara dengan penetrasi virus ke dalam darah. Upaya beberapa peneliti untuk membedakan fase enteral dan regional pada hepatitis B kurang didukung bukti. Ada lebih banyak alasan untuk percaya bahwa virus segera memasuki hati melalui aliran darah.
Tropisme virus hepatitis B terhadap jaringan hati ditentukan sebelumnya oleh keberadaan reseptor khusus dalam HBsAg - polipeptida dengan berat molekul 31.000 Da (P31), yang memiliki aktivitas pengikatan albumin. Zona albumin serupa juga ditemukan pada membran hepatosit di hati manusia dan simpanse, yang pada dasarnya menentukan tropisme HBV terhadap hati manusia dan simpanse.
Ketika virus menembus hepatosit, DNA virus dilepaskan, yang memasuki nukleus hepatosit dan bertindak sebagai matriks untuk sintesis asam nukleat, memicu serangkaian reaksi biologis berurutan, yang hasilnya adalah perakitan nukleokapsid virus. Nukleokapsid bermigrasi melalui membran nukleus ke dalam sitoplasma, tempat perakitan akhir partikel Dane - virus hepatitis B lengkap - terjadi.
Namun, perlu dicatat bahwa ketika hepatosit terinfeksi, prosesnya dapat berlangsung dalam dua cara - replikasi dan integratif. Dalam kasus pertama, gambaran hepatitis akut atau kronis berkembang, dan dalam kasus kedua, pembawa virus.
Alasan yang menentukan dua jenis interaksi antara DNA virus dan hepatosit belum ditetapkan secara pasti. Kemungkinan besar, jenis respons ditentukan secara genetik.
Hasil interaksi replikasi adalah perakitan struktur antigen inti (dalam nukleus) dan perakitan virus lengkap (dalam sitoplasma), diikuti oleh penyajian virus lengkap atau antigennya pada membran atau dalam struktur membran hepatosit.
Secara umum diterima bahwa replikasi virus tidak mengakibatkan kerusakan sel pada tingkat hepatosit, karena virus hepatitis B tidak memiliki efek sitopatik. Posisi ini tidak dapat dianggap tidak terbantahkan, karena didasarkan pada data eksperimen yang, meskipun menunjukkan tidak adanya efek sitopatik dari virus hepatitis B, diperoleh pada kultur jaringan dan karenanya tidak dapat sepenuhnya diekstrapolasi ke hepatitis B virus pada manusia. Bagaimanapun, masalah tidak adanya kerusakan hepatosit selama fase replikasi memerlukan studi tambahan.
Namun, terlepas dari sifat interaksi virus dengan sel, hati tentu saja terlibat dalam proses imunopatologis. Dalam hal ini, kerusakan hepatosit dikaitkan dengan fakta bahwa sebagai akibat dari ekspresi antigen virus pada membran hepatosit dan pelepasan antigen virus ke dalam sirkulasi bebas, serangkaian reaksi imun seluler dan humoral berurutan disertakan, yang pada akhirnya ditujukan untuk menghilangkan virus dari tubuh. Proses ini dilakukan sepenuhnya sesuai dengan pola umum respons imun terhadap infeksi virus. Untuk menghilangkan patogen, reaksi sitotoksik seluler disertakan, yang dimediasi oleh berbagai kelas sel efektor: sel K, sel T, pembunuh alami, makrofag. Selama reaksi ini, hepatosit yang terinfeksi dihancurkan, yang disertai dengan pelepasan antigen virus (HBcAg, HBeAg, HBsAg), yang memicu sistem genesis antibodi, sebagai akibatnya antibodi spesifik terakumulasi dalam darah, terutama terhadap inti - anti-HBc dan e-antigen - anti-HBE. Akibatnya, pelepasan sel hati dari virus terjadi dalam proses kematiannya karena reaksi sitolisis seluler.
Pada saat yang sama, antibodi spesifik yang terakumulasi dalam darah mengikat antigen virus, membentuk kompleks imun yang difagositosis oleh makrofag dan dikeluarkan oleh ginjal. Dalam kasus ini, berbagai lesi kompleks imun dapat terjadi dalam bentuk glomerulonefritis, arteritis, artralgia, ruam kulit, dll. Dengan partisipasi antibodi spesifik, tubuh dibersihkan dari patogen dan pemulihan total terjadi.
Sesuai dengan konsep patogenesis hepatitis B yang diuraikan, semua keragaman varian klinis perjalanan penyakit biasanya dijelaskan oleh kekhasan interaksi virus dan kerja sama sel imunokompeten, dengan kata lain, kekuatan respons imun terhadap keberadaan antigen virus. Menurut konsep modern, kekuatan respons imun ditentukan secara genetik dan terkait dengan antigen histokompatibilitas lokus HLA kelas pertama.
Secara umum diterima bahwa dalam kondisi respons imun yang memadai terhadap antigen virus, hepatitis akut berkembang secara klinis dengan perjalanan siklus dan pemulihan total. Dengan latar belakang penurunan respons imun terhadap antigen virus, sitolisis yang dimediasi imun diekspresikan secara tidak signifikan, oleh karena itu, tidak ada eliminasi sel hati yang terinfeksi secara efektif, yang mengarah pada manifestasi klinis ringan dengan persistensi virus jangka panjang dan, mungkin, perkembangan hepatitis kronis. Pada saat yang sama, sebaliknya, dalam kasus respons imun kuat yang ditentukan secara genetik dan infeksi masif (hemotransfusi), area kerusakan sel hati yang luas muncul, yang secara klinis sesuai dengan bentuk penyakit yang parah dan ganas.
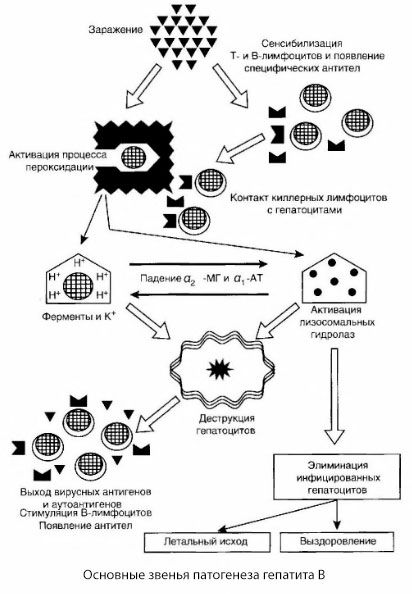
Skema patogenesis hepatitis B yang disajikan dibedakan oleh koherensinya; namun, skema ini mengandung sejumlah poin yang kontroversial dan kurang dipelajari.
Jika kita mengikuti konsep hepatitis B sebagai penyakit imunopatologis, kita dapat mengharapkan peningkatan reaksi sitotoksisitas seluler dengan meningkatnya keparahan penyakit. Namun, dalam bentuk yang parah, indeks hubungan seluler imunitas berkurang tajam, termasuk penurunan berganda, dibandingkan dengan anak-anak yang sehat, dan indeks sitotoksisitas sel K. Dalam bentuk ganas, selama periode perkembangan nekrosis hati masif dan terutama koma hepatik, ketidakmampuan total limfosit untuk melakukan transformasi blast di bawah pengaruh fitohematlutinin, endotoksin stafilokokus, dan HBsAg dicatat. Selain itu, tidak ada kemampuan leukosit untuk bermigrasi sesuai dengan reaksi penghambatan migrasi leukosit (LMIC), dan peningkatan tajam dalam permeabilitas membran limfosit terungkap menurut hasil penelitian mereka menggunakan probe tetrasiklin fluoresen.
Dengan demikian, jika indeks fluoresensi limfosit pada orang sehat adalah 9,9±2%, dan pada hepatitis B tipikal dengan perjalanan jinak meningkat menjadi 22,3±2,7%, maka pada bentuk ganas jumlah limfosit fluoresen mencapai rata-rata 63,5±5,8%. Karena peningkatan permeabilitas membran sel dinilai dengan jelas dalam literatur sebagai indikator yang dapat diandalkan dari inferioritas fungsionalnya, dapat disimpulkan bahwa dengan hepatitis B, terutama dalam bentuk ganas, ada kerusakan besar pada limfosit. Ini juga dibuktikan dengan indeks sitotoksisitas sel K. Dalam bentuk yang parah, pada minggu ke-1-2 penyakit, sitotoksisitas adalah 15,5±8,8%, dan dalam bentuk ganas pada minggu ke-1 - 6,0±2,6, pada minggu ke-2 - 22,0±6,3% dengan norma 44,8±2,6%.
Data yang disajikan dengan jelas menunjukkan adanya gangguan yang nyata pada hubungan seluler imunitas pada pasien dengan hepatitis B berat. Jelas juga bahwa perubahan ini terjadi secara sekunder, sebagai akibat kerusakan sel imunokompeten oleh metabolit toksik dan, mungkin, kompleks imun yang beredar.
Sebagaimana telah dibuktikan oleh berbagai penelitian, pada pasien dengan hepatitis B berat, terutama pada kasus perkembangan nekrosis hati masif, titer HBsAg dan HBeAg dalam serum darah menurun dan pada saat bersamaan antibodi terhadap antigen permukaan mulai terdeteksi dalam titer tinggi, yang sama sekali tidak khas untuk bentuk penyakit jinak, di mana anti-HBV hanya muncul pada bulan ke-3 hingga ke-5 penyakit.
Hilangnya antigen virus hepatitis B secara cepat disertai munculnya titer antibodi antivirus yang tinggi menunjukkan adanya pembentukan kompleks imun secara intensif dan kemungkinan keterlibatannya dalam patogenesis perkembangan nekrosis hati masif.
Dengan demikian, materi faktual tidak memungkinkan kita untuk menafsirkan hepatitis B secara tidak ambigu hanya dari sudut pandang agresi imunopatologis. Dan intinya bukan hanya tidak ditemukannya hubungan antara kedalaman dan prevalensi perubahan morfologis di hati, di satu sisi, dan tingkat keparahan faktor imunitas seluler, di sisi lain. Secara teoritis, keadaan ini dapat dijelaskan oleh tahap akhir studi indikator imunitas seluler, ketika sel imunokompeten mengalami efek toksik yang kuat karena meningkatnya insufisiensi fungsional hati. Tentu saja, dapat diasumsikan bahwa sitolisis imun hepatosit terjadi pada tahap paling awal dari proses infeksi, bahkan mungkin sebelum munculnya gejala klinis kerusakan hati yang parah. Namun, asumsi seperti itu tidak mungkin, karena indikator imunitas seluler yang serupa terdeteksi pada pasien dengan perjalanan penyakit yang paling akut (kilat) dan, sebagai tambahan, selama pemeriksaan morfologis jaringan hati, infiltrasi limfosit masif tidak terdeteksi, sementara pada saat yang sama, bidang epitel nekrotik terus menerus terdeteksi tanpa fenomena resorpsi dan agresi limfosit.
Sangat sulit untuk menjelaskan gambaran morfologi hepatitis akut hanya dari sudut pandang sitolisis sel imun, oleh karena itu, dalam penelitian awal, efek sitotoksik virus hepatitis B tidak dikecualikan.
Saat ini, asumsi ini sebagian telah dikonfirmasi oleh penemuan virus hepatitis B. Seperti yang telah ditunjukkan oleh penelitian, frekuensi deteksi penanda hepatitis D secara langsung bergantung pada tingkat keparahan penyakit: dalam bentuk ringan, penanda terdeteksi pada 14%, sedang - pada 18%, parah - pada 30%, dan ganas - pada 52% pasien. Mengingat bahwa virus hepatitis D memiliki efek sitopatik nekrosogenik, dapat dianggap mapan bahwa koinfeksi dengan virus hepatitis B dan D sangat penting dalam perkembangan bentuk hepatitis B fulminan.
Patogenesis hepatitis B dapat dijelaskan sebagai berikut. Setelah virus hepatitis B masuk ke dalam hepatosit, terjadi serangan imunologis terhadap hepatosit yang terinfeksi oleh sel T pembunuh yang mengeluarkan limfotoksin ke arah sel hati.
Mekanisme kerusakan hepatosit pada hepatitis B belum diketahui secara pasti. Peran utama dimainkan oleh proses aktif peroksidasi lipid dan hidrolase lisosomal. Pemicunya mungkin limfotoksin yang dilepaskan dari sel efektor setelah kontak dengan hepatosit, tetapi ada kemungkinan bahwa virus itu sendiri mungkin merupakan inisiator proses peroksidasi. Selanjutnya, proses patologis kemungkinan besar berkembang dalam urutan berikut.
- Interaksi faktor agresi (limfotoksin atau virus) dengan makromolekul biologis (mungkin dengan komponen membran retikulum endoplasma yang mampu berpartisipasi dalam proses detoksifikasi, dengan analogi dengan agen perusak lainnya, seperti yang ditunjukkan dalam kaitannya dengan karbon tetraklorida).
- Pembentukan radikal bebas, aktivasi proses peroksidasi lipid dan peningkatan permeabilitas semua membran hepatosit (sindrom sitolisis).
- Pergerakan zat aktif biologis sepanjang gradien konsentrasi - hilangnya enzim dari berbagai lokalisasi intraseluler, donor energi, kalium, dll. Akumulasi natrium dan kalsium dalam sel, pergeseran pH menuju asidosis intraseluler.
- Aktivasi dan pelepasan hidrolase lisosomal (RNAse, DNAse, cathepsin, dll.) dengan pemecahan sel hati dan pelepasan autoantigen.
- Stimulasi sistem imun T dan B dengan pembentukan sensitisasi spesifik limfosit T terhadap lipoprotein hati, serta pembentukan autoantibodi humoral antihepatik.
Dalam skema patogenesis hepatitis B yang diusulkan, faktor pemicunya adalah antigen virus, yang produksinya yang intensif diamati pada tahap paling awal penyakit dan sepanjang periode akut, dengan pengecualian bentuk ganas, di mana produksi antigen virus praktis berhenti pada saat perkembangan nekrosis hati masif, yang menentukan penurunan cepat dalam replikasi virus.
Jelas juga bahwa antigen virus mengaktifkan sistem kekebalan T dan B. Selama proses ini, terjadi redistribusi karakteristik subpopulasi limfosit T, yang bertujuan untuk mengatur respons imun yang memadai, menghilangkan hepatosit yang terinfeksi, menetralkan antigen virus, sanogenesis, dan pemulihan.
Ketika sel imunokompeten berinteraksi dengan antigen virus pada membran hepatosit atau selama reproduksi virus di dalam hepatosit, timbul kondisi untuk aktivasi proses peroksidasi lipid, yang, seperti diketahui, mengendalikan permeabilitas semua membran seluler dan subseluler.
Dari posisi ini, terjadinya sindrom sitolisis, peningkatan permeabilitas membran sel, yang sangat alami dan sangat khas pada hepatitis virus, menjadi dapat dipahami.
Hasil akhir dari sindrom sitolisis mungkin berupa pelepasan lengkap fosforilasi oksidatif, kebocoran materi seluler, dan kematian parenkim hati.
Namun, dalam sebagian besar kasus, proses ini tidak berkembang menjadi fatal. Hanya dalam bentuk penyakit ganas, proses patologis berlangsung seperti longsoran salju dan tidak dapat diubah lagi, karena infeksi masif, proses kekebalan yang jelas, aktivasi berlebihan proses peroksidasi dan hidrodase lisosom, dan fenomena agresi autoimun terjadi.
Mekanisme yang sama diamati dalam perjalanan hepatitis B yang menguntungkan, dengan satu-satunya kekhasan bahwa semuanya terwujud pada tingkat yang berbeda secara kualitatif. Tidak seperti kasus nekrosis hati masif, dalam perjalanan penyakit yang menguntungkan jumlah hepatosit yang terinfeksi, dan oleh karena itu zona sitolisis imunopatologis lebih kecil, proses peroksidasi lipid tidak ditingkatkan secara signifikan, aktivasi hidrolase asam hanya mengarah pada autolisis terbatas dengan pelepasan autoantigen yang tidak signifikan, dan oleh karena itu, tanpa autoagresi masif, yaitu, semua tahap patogenesis dalam perjalanan yang menguntungkan dilakukan dalam kerangka organisasi struktural parenkim hati yang terpelihara dan ditahan oleh sistem pertahanan (antioksidan, inhibitor, dll.) dan oleh karena itu tidak memiliki efek yang merusak.
Penyebab gejala keracunan pada hepatitis virus belum sepenuhnya dipelajari. Usulan untuk membedakan antara apa yang disebut keracunan primer, atau virus, dan sekunder (pertukaran, atau metabolik) dapat dianggap positif, meskipun ini tidak mengungkapkan mekanisme intim terjadinya sindrom toksik umum. Pertama, virus hepatitis tidak memiliki sifat toksik, dan kedua, konsentrasi banyak metabolit tidak selalu berkorelasi dengan tingkat keparahan penyakit dan tingkat ekspresi gejala toksikosis. Diketahui juga bahwa konsentrasi antigen virus tidak sepenuhnya berkorelasi dengan tingkat keparahan keracunan. Sebaliknya, dengan peningkatan keparahan penyakit, dan oleh karena itu, peningkatan derajat toksikosis, konsentrasi HBsAg menurun dan terendah dalam bentuk ganas pada saat timbulnya koma hepatik yang dalam. Pada saat yang sama, frekuensi deteksi dan titer antibodi antivirus spesifik secara langsung bergantung pada tingkat keparahan penyakit.
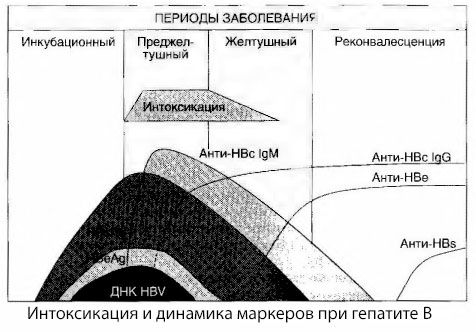
Keracunan tidak muncul pada saat antigen virus didaftarkan, tetapi selama periode sirkulasi antibodi antivirus kelas IgM terhadap antigen sapi dan antigen sistem E dalam darah. Selain itu, dalam bentuk yang parah dan terutama ganas, sebagian besar pasien bahkan memiliki anti-HBs dalam darah, yang biasanya tidak pernah diamati dalam bentuk penyakit yang ringan dan sedang.
Data yang disajikan memungkinkan kita untuk menyimpulkan bahwa sindrom toksikosis pada hepatitis virus, dan khususnya hepatitis B, tidak muncul sebagai akibat dari munculnya antigen virus dalam darah, tetapi merupakan konsekuensi dari interaksi antigen virus dengan antibodi antivirus kelas IgM. Hasil dari interaksi tersebut, seperti diketahui, adalah pembentukan kompleks imun dan, mungkin, zat toksik aktif.
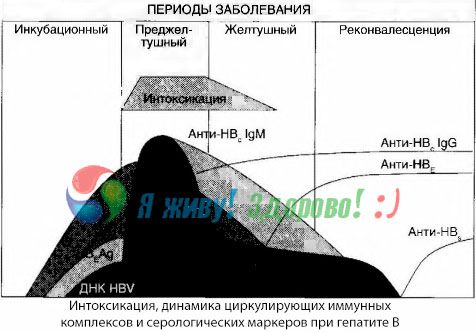
Gejala keracunan timbul pada saat munculnya kompleks imun dalam sirkulasi bebas, tetapi kemudian korelasi seperti itu tidak diamati.
Penjelasan parsial untuk hal ini dapat ditemukan dalam studi tentang komposisi kompleks imun. Pada pasien dengan bentuk yang parah, sebagian besar kompleks berukuran sedang beredar dalam darah, dan dalam komposisinya, pada puncak sindrom toksik, antibodi kelas tersebut mendominasi, sedangkan selama periode penurunan manifestasi klinis dan pemulihan, kompleks menjadi lebih besar, dan dalam komposisinya, antibodi kelas IgG mulai mendominasi.
Data yang disajikan menyangkut mekanisme perkembangan sindrom toksik pada periode awal penyakit, tetapi pada toksikosis yang terjadi pada puncak manifestasi klinis, data tersebut hanya memiliki signifikansi parsial, dan terutama dalam perkembangan koma hepatik.
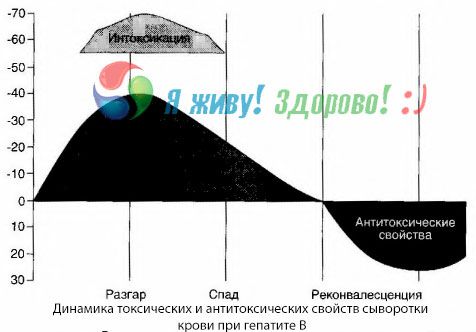
Metode kultur darah telah menunjukkan bahwa pada hepatitis B, racun terus-menerus terakumulasi dalam darah, dilepaskan dari jaringan hati yang rusak dan membusuk. Konsentrasi racun ini sebanding dengan tingkat keparahan penyakit, dan bersifat protein.
Selama masa pemulihan, antibodi terhadap toksin ini muncul dalam darah; tetapi pada kasus koma hepatik, konsentrasi toksin dalam darah meningkat tajam, dan antibodi tidak terdeteksi dalam darah.
Patomorfologi Hepatitis B
Berdasarkan sifat perubahan morfologinya, hepatitis B akut dibedakan menjadi tiga bentuk:
- bentuk siklus,
- nekrosis hati masif;
- hepatitis perikolangiolitik kolestatik.
Pada hepatitis B bentuk siklik, perubahan distrofik, inflamasi, dan proliferatif lebih menonjol di bagian tengah lobulus, sedangkan pada hepatitis A perubahan tersebut terlokalisasi di sepanjang tepi lobulus dan menyebar ke bagian tengah. Perbedaan ini disebabkan oleh rute penetrasi virus yang berbeda ke dalam parenkim hati. Virus hepatitis A memasuki hati melalui vena porta dan menyebar ke bagian tengah lobulus, sedangkan virus hepatitis B menembus arteri hepatik dan cabang kapiler yang secara merata mensuplai semua lobulus hingga ke bagian tengahnya.
Tingkat kerusakan parenkim hati dalam kebanyakan kasus sesuai dengan tingkat keparahan manifestasi klinis penyakit. Dalam bentuk ringan, nekrosis fokal hepatosit biasanya diamati, dan dalam bentuk sedang dan berat - nekrosis zonal (dengan kecenderungan untuk bergabung dan membentuk nekrosis seperti jembatan dalam bentuk penyakit yang parah).
Perubahan morfologi terbesar pada parenkim diamati pada puncak manifestasi klinis, yang biasanya bertepatan dengan dekade pertama penyakit. Selama dekade ke-2 dan terutama dekade ke-3, proses regenerasi meningkat. Pada periode ini, perubahan nekrobiotik hampir sepenuhnya menghilang dan proses infiltrasi seluler mulai mendominasi dengan pemulihan lambat struktur lempeng hepatoseluler. Namun, pemulihan lengkap struktur dan fungsi parenkim hati terjadi hanya 3-6 bulan setelah timbulnya penyakit dan tidak pada semua pasien.
Sifat umum infeksi hepatitis B dikonfirmasi oleh deteksi HBsAg tidak hanya pada hepatosit, tetapi juga pada ginjal, paru-paru, limpa, pankreas, sel sumsum tulang, dll.
Hepatitis kolestatik (pericholangiolytic) merupakan bentuk khusus dari penyakit ini, di mana perubahan morfologi terbesar ditemukan pada bagian saluran empedu intrahepatik, dengan gambaran kolangiolitis dan pericholangiolitis. Dalam bentuk kolestatik, kolestasis terjadi dengan pelebaran kapiler empedu dengan stasis empedu di dalamnya, dengan proliferasi kolangiol dan infiltrat seluler di sekitarnya. Sel-sel hati terpengaruh secara tidak signifikan dalam bentuk hepatitis ini. Secara klinis, penyakit ini ditandai dengan perjalanan penyakit yang berlarut-larut dengan penyakit kuning yang berkepanjangan. Telah ditunjukkan bahwa penyebab perjalanan penyakit yang aneh tersebut adalah efek dominan virus pada dinding kolangiol dengan efek yang tidak signifikan pada hepatosit.

