
Semua konten iLive ditinjau secara medis atau diperiksa fakta untuk memastikan akurasi faktual sebanyak mungkin.
Kami memiliki panduan sumber yang ketat dan hanya menautkan ke situs media terkemuka, lembaga penelitian akademik, dan, jika mungkin, studi yang ditinjau secara medis oleh rekan sejawat. Perhatikan bahwa angka dalam tanda kurung ([1], [2], dll.) Adalah tautan yang dapat diklik untuk studi ini.
Jika Anda merasa salah satu konten kami tidak akurat, ketinggalan zaman, atau dipertanyakan, pilih dan tekan Ctrl + Enter.
Rabies pada anak-anak
Ahli medis artikel
Terakhir ditinjau: 04.07.2025
Rabies, atau hidrofobia, adalah penyakit virus akut yang ditularkan melalui gigitan hewan yang terinfeksi, dengan kerusakan pada sistem saraf dan perkembangan ensefalitis parah dengan hasil yang fatal.
Epidemiologi
Virus rabies, yang telah menjadi momok kesehatan masyarakat sejak zaman dahulu, kini menyebabkan sekitar 59.000 kematian manusia setiap tahun, yang hampir semuanya ditularkan melalui gigitan anjing. Hal ini berdampak signifikan terhadap negara-negara berkembang, khususnya di Afrika dan Asia, yang dapat menanggung kerugian paling sedikit. Namun, meskipun tingkat kematiannya hampir 100%, rabies anjing merupakan penyakit yang sepenuhnya dapat dicegah, dan contoh-contoh historis pemberantasan rabies anjing di negara-negara maju membuktikan hal ini. [ 1 ]
Penyebab rabies
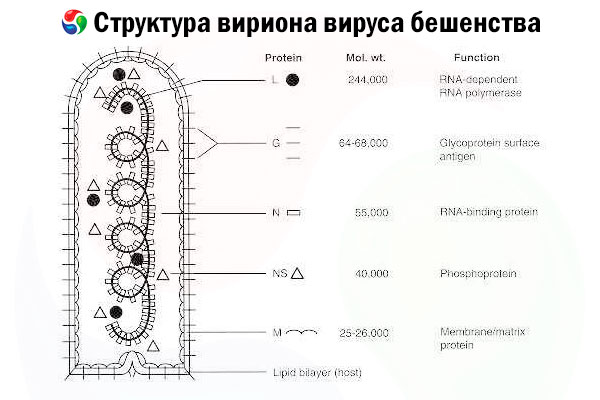
Agen penyebabnya adalah virus rabies (RV), virus RNA untai negatif dari famili rhabdovirus, berukuran sekitar 60 nm × 180 nm.
Terdiri dari inti protein bagian dalam, atau nukleokapsid, yang mengandung asam nukleat, dan membran luar, lapisan ganda yang mengandung lipid yang ditutupi dengan paku glikoprotein transmembran. Struktur genom modularnya relatif sederhana dan mengkodekan lima protein struktural:
- RNA polimerase bergantung RNA (L),
- nukleoprotein (N),
- protein terfosforilasi (P),
- protein matriks (M) dan
- glikoprotein permukaan luar (G).
Protein N, P, dan L bersama dengan RNA genomik membentuk kompleks ribonukleoprotein. G adalah satu-satunya antigen RV yang mampu menginduksi produksi antibodi penetral RV, yang merupakan efektor imun utama terhadap infeksi RV yang mematikan. Di sisi lain, kompleks ribonukleoprotein telah terbukti menjadi antigen RV utama yang mampu menginduksi sel T CD4+, yang dapat meningkatkan produksi antibodi penetral RV melalui pengenalan antigen intrastruktural.[ 2 ] Kompleks ribonukleoprotein dapat memainkan peran penting dalam pembentukan memori imunologis dan imunitas jangka panjang.[ 3 ]
Klasifikasi dan jenis antigen
Genus Lyssavirus mencakup virus rabies dan virus rabies yang terkait secara antigenik dan genetik: virus kelelawar Lagos, Mokola, dan Duvenhage, serta dua subtipe dugaan lyssavirus kelelawar Eropa. Studi perlindungan silang menunjukkan bahwa hewan yang diimunisasi dengan vaksin rabies tradisional mungkin tidak sepenuhnya terlindungi saat dilawan dengan lyssavirus lain.
Virus rabies dapat diklasifikasikan sebagai virus tetap (beradaptasi melalui penularan pada hewan atau kultur sel) atau virus liar (tipe liar). Penggunaan antibodi monoklonal dan sekuensing genetik untuk membedakan virus rabies liar telah membantu dalam mengidentifikasi varian virus yang berasal dari reservoir inang utama di seluruh dunia dan dalam menyarankan kemungkinan sumber paparan manusia ketika riwayat gigitan hewan yang pasti tidak ada dalam kasus pasien.[ 8 ]
Patogenesis
Reservoir dan sumber utama infeksi di antara hewan liar adalah serigala, rubah, anjing hutan, kelelawar, dan di antara hewan peliharaan - anjing dan kucing, jarang - kuda, sapi, babi, tikus, dll. Penularan infeksi dari orang ke orang, meskipun mungkin, sangat jarang. Ini adalah infeksi zoonosis yang umum. Orang terinfeksi rabies terutama dari anjing.
Setelah manusia digigit hewan yang sakit, virus berkembang biak di jaringan otot di lokasi gigitan, dan kemudian, setelah mencapai ujung saraf tepi sensorik, menyebar secara sentripetal, mencapai neuron motorik. Waktu yang dibutuhkan virus untuk bergerak dan otak terpengaruh tergantung pada lokasi gigitan. Dalam kasus gigitan parah di kepala dan wajah, virus dapat mencapai sistem saraf pusat dalam 15-20 hari, dan dalam kasus kerusakan kecil pada kulit batang tubuh dan anggota badan dan, akibatnya, dosis kecil patogen, proses pemindahan virus ke sistem saraf pusat dapat tertunda selama beberapa bulan atau bahkan hingga 1-1,5 tahun. Setelah mencapai sistem saraf pusat, virus terfiksasi di jaringan otak dan sumsum tulang belakang, terutama di neuron medula oblongata, tanduk Ammon, dan dasar otak. Di sumsum tulang belakang, tanduk posterior paling terpengaruh. Dari susunan saraf pusat, virus bergerak secara sentrifugal sepanjang batang saraf menuju kelenjar ludah, tempat ia berkembang biak dan dikeluarkan bersama air liur.
Konsep dalam patogenesis rabies
RV memiliki kisaran inang yang luas dan dapat menginfeksi hampir semua mamalia. Meskipun beberapa rute penularan RV telah dilaporkan, infeksi alami paling sering terjadi melalui gigitan. Selain gigitan, konsumsi bangkai yang terinfeksi RV dapat meningkatkan infeksi virus rabies pada rubah Arktik, dan kontak RV dengan selaput lendir telah ditemukan sebagai rute penularan lain yang mungkin.[ 9 ] Dalam beberapa keadaan yang tidak biasa, seperti pelepasan RV secara tidak sengaja sebagai aerosol di laboratorium atau RV sebagai aerosol di gua yang dihuni oleh sejumlah besar kelelawar,[ 10 ] penularan aerosol dapat terjadi.
Masih belum jelas apakah strain RV jalanan dan strain RV yang beradaptasi dengan tikus atau yang beradaptasi dengan kultur jaringan bereplikasi di tempat inokulasi sebelum memasuki SSP. Sementara infeksi intramuskular eksperimental pada hamster atau rakun muda dengan RV jalanan mengungkap replikasi RV dalam sel otot lurik sebelum virus menginvasi akson neuron motorik melalui sambungan neuromuskular,[ 11 ],[ 12 ] infeksi intramuskular pada tikus dengan RV CVS-24 yang beradaptasi dengan tikus memperlihatkan bahwa RV bermigrasi langsung ke SSP tanpa replikasi sebelumnya di tempat inokulasi.[ 13 ] Begitu berada di terminal akson tak bermielin, RV diangkut secara retrograde ke badan sel.
Temuan baru-baru ini menunjukkan bahwa transportasi vesikel akson dapat mewakili strategi kunci untuk pergerakan virion jarak jauh dalam akson.[ 14 ] Diperkirakan bahwa RV bermigrasi dalam akson pada kecepatan 3 mm/jam.[ 15 ] Infeksi kemudian menyebar melalui rantai neuron yang dihubungkan oleh sambungan sinaptik. Namun, mekanisme pasti yang mendorong penyebaran transsinaptik masih belum diketahui. Setelah menginfeksi otak, virus menyebar secara sentrifugal ke sistem saraf perifer dan otonom di banyak organ perifer.[ 16 ] Pada tahap terakhir siklus infeksi, RV bermigrasi ke kelenjar ludah; setelah replikasi dalam sel asinus mukogenik, ia dilepaskan ke dalam air liur dan siap untuk ditularkan ke inang berikutnya.[ 17 ]
Mengenai patologi yang diinduksi virus rabies, kematian sel apoptosis telah diusulkan sebagai mekanisme patogenik potensial dalam model rabies eksperimental tikus yang terinfeksi dengan strain RV yang tetap.[ 18 ] Mekanisme patogenik yang dapat berkontribusi terhadap disfungsi SSP yang mendalam yang menjadi ciri rabies mungkin adalah gangguan fungsi neuron. Ekspresi gen telah terbukti sangat berkurang pada neuron yang terinfeksi RV, yang mengakibatkan penekanan umum sintesis protein,[ 19 ] dan beberapa penelitian telah menunjukkan gangguan neurotransmisi setelah infeksi RV. Jiang menunjukkan bahwa pengikatan antagonis reseptor asetilkolin pada homogenat otak tikus yang terinfeksi berkurang dibandingkan dengan kontrol.[ 20 ] Pelepasan dan pengikatan serotonin yang terganggu, neurotransmitter yang terlibat dalam pengendalian siklus tidur, persepsi nyeri, dan perilaku, juga diamati pada otak tikus yang terinfeksi RV. [ 21 ], [ 22 ] Selain memengaruhi neurotransmisi, infeksi ventrikel kanan juga dapat memengaruhi saluran ion. Sel neuroblastoma tikus yang terinfeksi menunjukkan penurunan ekspresi fungsional saluran natrium yang dikendalikan tegangan, yang dapat mencegah potensial aksi dan akhirnya menyebabkan gangguan fungsional. [ 23 ]
Selain tidak adanya lesi patologis serius di SSP, sebagian besar kasus rabies pada manusia tidak menimbulkan respons imun 7 hingga 10 hari setelah timbulnya tanda-tanda klinis. Perbedaan yang mendalam antara patogenesis rabies dan sebagian besar infeksi SSP virus atau bakteri lainnya didukung oleh fakta bahwa imunosupresi tidak efektif atau merugikan hasil rabies.[ 24 ] Tingkat respons imun rendah yang sering diamati pada korban rabies membingungkan karena tidak dapat dijelaskan oleh imunogenisitas antigen RV yang buruk. Faktanya, RV G dan protein nukleokapsid merupakan antigen sel B dan T yang kuat ketika diberikan secara parenteral. [ 25 ] Penjelasan yang mungkin untuk tingkat respons imun rendah terhadap RV pada manusia atau hewan dengan rabies mungkin adalah bahwa infeksi RV pada SSP menyebabkan imunosupresi, [ 26 ] dan telah diusulkan bahwa RV menggunakan strategi subversif termasuk mencegah apoptosis dan menghancurkan sel T yang menyerang. [ 27 ]
Strain RV yang dilemahkan yang telah beradaptasi dengan sel non-neuron berbeda secara signifikan dari strain RV jalanan patogenik dalam hal neuroinvasifnya, yang mengacu pada kemampuannya untuk menyerang SSP dari lokasi perifer. Dalam hal ini, strain RV yang beradaptasi dengan kultur jaringan tidak memiliki atau hanya memiliki kemampuan terbatas untuk menyerang SSP dari lokasi perifer, sedangkan strain RV jalanan atau strain RV yang beradaptasi dengan tikus seperti CVS-24 sangat invasif.[ 28 ] Faktor-faktor utama yang terlibat dalam neuroinvasi RV meliputi penyerapan virus, transportasi akson, penyebaran trans-sinaptik, dan laju replikasi virus.
Hingga saat ini, pengetahuan kita tentang patogenesis RV terbatas dan terutama didasarkan pada studi deskriptif tentang galur RV jalanan atau infeksi eksperimental dengan galur yang dilemahkan yang diadaptasi di laboratorium. Munculnya teknologi genetika terbalik telah memungkinkan kita untuk mengidentifikasi elemen virus yang menentukan fenotipe patogenik RV dan untuk lebih memahami mekanisme yang terlibat dalam patogenesis rabies.
Identifikasi elemen virus yang mengendalikan perolehan, penyebaran dan replikasi virus rabies
- Elemen virus yang terlibat dalam penangkapan virus
Infeksi RV dimulai dengan perlekatan virus ke reseptor seluler putatif. Meskipun beberapa molekul permukaan membran telah diusulkan sebagai reseptor RV, termasuk reseptor asetilkolin nikotinik,[ 29 ] molekul adhesi sel saraf[ 30 ] dan reseptor neurotrofin afinitas rendah p75 NTR,[ 31 ] masih belum jelas apakah molekul-molekul ini benar-benar berperan dalam siklus hidup virus rabies. Dalam konteks ini, baru-baru ini ditunjukkan bahwa interaksi RV G–p75 NTR tidak diperlukan untuk infeksi RV pada neuron primer.[ 32 ] Setelah pengikatan reseptor, RV diinternalisasi melalui endositosis adsorptif atau yang dimediasi reseptor. [ 33 ] Lingkungan pH rendah dalam kompartemen endosomal kemudian menginduksi perubahan konformasi pada RV G yang memicu fusi membran virus dengan membran endosomal, sehingga melepaskan RNP ke dalam sitoplasma. [ 34 ] Untuk virus, RV G memainkan peran penting dalam penyerapan virus, kemungkinan besar melalui interaksi dengan reseptor seluler putatif yang memfasilitasi penyerapan cepat. Dalam hal ini, telah ditunjukkan bahwa patogenisitas strain RV yang beradaptasi dengan kultur jaringan (misalnya, ERA, HEP, dan CVS-11) berkorelasi dengan keberadaan determinan yang terletak di situs antigenik III protein G. [ 35 ] Mutasi Arg → Gln pada posisi 333 di situs antigenik protein G ERA ini mengakibatkan penundaan tujuh kali lipat dalam internalisasi varian RV Gln333 dibandingkan dengan varian tipe liar. Mutasi Asn194→Lys194 di RV G, yang menjelaskan kemunculan kembali fenotipe patogenik, dikaitkan dengan penurunan signifikan dalam waktu internalisasi.[ 36 ] Lebih jauh lagi, percobaan dengan RV chimeric menunjukkan bahwa waktu yang dibutuhkan untuk internalisasi virion RV meningkat secara signifikan dan patogenisitas sangat berkurang setelah penggantian gen G dari strain RV SB yang sangat patogenik, yang berasal dari klon cDNA strain RV-18 yang berasosiasi dengan kelelawar yang berasal dari perak,[ 37 ] dengan strain SN yang sangat dilemahkan, yang diisolasi dari klon cDNA strain vaksin RV SAD B19.[ 38 ] Bersama-sama, data ini mendukung gagasan bahwa kinetika penyerapan virus, yang merupakan fungsi dari RV G, merupakan penentu utama patogenisitas RV.
- Elemen virus yang terlibat dalam penyebaran dan penularan virus
Sifat unik virus rabies adalah kemampuannya untuk menyebar dari sel ke sel. Pengamatan bahwa varian Gln333 ERA kehilangan aktivitas fusi sel-ke-sel yang bergantung pada pH secara in vitro [ 39 ] dan menunjukkan kemampuan yang sangat berkurang untuk menyebar dari sel ke sel [ 40 ] menunjukkan bahwa RV G juga memainkan peran penting dalam penyebaran sel-ke-sel dan karenanya penularan virus, kemungkinan melalui aktivitas fusiogeniknya. Kemungkinan ini selanjutnya didukung oleh temuan bahwa tingkat penyebaran SPBNGAK revertan RV patogenik hampir dua kali lebih tinggi daripada yang ditentukan untuk varian SPBNGA non-patogenik. Menariknya, mutasi Asn 194 → Lys 194 di G SPBNGAK menyebabkan pergeseran ambang batas pH untuk fusi membran ke pH yang lebih tinggi, mendukung hipotesis bahwa ambang batas pH yang lebih tinggi untuk fusi membran dikaitkan dengan peningkatan penyebaran virus. [ 41 ]
Studi indikator transneuronal infeksi RV pada tikus [ 42 ] dan monyet rhesus [ 43 ] telah menunjukkan bahwa virus rabies bermigrasi secara eksklusif dalam arah retrograde di akson. Meskipun beberapa protein RV terlibat dalam mekanisme transportasi neuronal, RV G tampaknya memainkan peran dominan dalam penyebaran transneuronal infeksi RV. Misalnya, sementara infeksi perifer dengan virus anemia infeksius kuda (EIAV) pseudotyped dengan RV G mengakibatkan transfer virus ke sumsum tulang belakang, EIAV yang sama pseudotyped dengan virus stomatitis vesikular G gagal memasuki sistem saraf. [ 44 ] Lebih jauh, penyebaran virus mutan ERA G Arg 333 → Gln 333 di SSP ditemukan sangat berkurang dibandingkan dengan mutan tipe liar, lebih lanjut menunjukkan fungsi RV G utuh dalam penyebaran trans-sinaptik. Namun, bukti paling kuat untuk peran penting RV G dalam transpor sinaptik datang dari infeksi intrakranial tikus dengan virus RV rekombinan yang kekurangan G, yang menunjukkan bahwa infeksi tetap terbatas pada neuron di tempat inokulasi tanpa bukti penyebaran ke neuron sekunder.[ 45 ] Namun, kemungkinan bahwa selain RV G, RV M juga berperan dalam penyebaran virus dan karenanya dalam transpor sinaptik. Dalam hal ini, ditunjukkan bahwa penyebaran varian RV SN-BMBG chimeric, yang mengandung M dan G dari SB yang sangat patogen, secara signifikan lebih tinggi daripada penyebaran varian SN-BG atau SN-BM chimeric, yang masing-masing mengandung G dan M dari SB, yang menunjukkan bahwa interaksi optimal M dengan G dapat memainkan peran penting dalam penyebaran virus dari sel ke sel. [ 46 ] Karena RV M mendukung pembentukan tunas virus, [ 47 ] kemungkinan besar penyebaran varian chimeric RV SN-BMBG yang lebih efisien disebabkan oleh pembentukan tunas virus yang optimal di membran postsinaptik.
Penelitian terkini telah menunjukkan bahwa interaksi antara RV P dan rantai ringan dynein menghubungkan RNP RV ke sistem transpor sel inang, sehingga memfasilitasi transpor akson retrograde virus.[ 48 ],[ 49 ] Namun, infeksi perifer pada tikus dewasa menunjukkan bahwa penghapusan domain pengikat LC8 dari RV P tidak mencegah masuknya virus ke dalam SSP, yang menunjukkan bahwa protein RV tidak terlibat langsung dalam penyebaran akson retrograde RV.[ 50 ]
- Elemen virus yang mengendalikan replikasi virus
Tidak seperti banyak virus lain, seperti virus influenza, patogenisitas RV berbanding terbalik dengan laju sintesis RNA virus dan produksi partikel virus yang menular. Perbandingan tingkat mRNA virus dan RNA genom yang diproduksi oleh berbagai virus chimeric menunjukkan bahwa transkripsi dan replikasi RNA virus diatur oleh banyak faktor, termasuk RV M, yang telah diidentifikasi sebagai faktor trans-acting yang memediasi peralihan dari tingkat awal sintesis mRNA yang tinggi ke sintesis RNA genom.[ 51 ] Lebih jauh, M dari semua rhabdovirus mampu mematikan ekspresi gen virus dengan mengikat RNP, sehingga menghasilkan pembentukan struktur seperti tulang punggung yang sangat padat yang tidak dapat mendukung sintesis RNA.
Untuk mengidentifikasi elemen virus lain yang mengendalikan patogenisitas dengan mengatur replikasi virus, urutan terminal 5' dari galur SB yang sangat patogenik diganti secara bertahap dengan urutan dari galur vaksin SN yang sangat dilemahkan, sehingga menghasilkan virus rekombinan SB2 (urutan terminal [TS] + L), SB3 (TS + L + pseudogen [Ψ]), SB4 (TS + L + Ψ + G), dan SB5 (TS + L + Ψ + G + M). Infeksi intramuskular dengan virus SB dan SN parental dan RV chimeric SB2, SB3, SB4, dan SB5 menimbulkan tingkat kematian tertinggi pada tikus yang terinfeksi SB dan tidak ada morbiditas atau mortalitas pada tikus yang terinfeksi SN. Penggantian TS, L, dan SB dengan elemen yang sesuai dari SN menghasilkan pengurangan yang sederhana dalam morbiditas dan mortalitas, dan pertukaran G atau G plus M tambahan sangat mengurangi atau sepenuhnya menghilangkan patogenisitas virus.
Karakterisasi fenotipik RV tipe liar dan chimeric ini dalam kultur jaringan mengungkapkan bahwa patogenisitas RV tertentu berkorelasi terbalik dengan kemampuannya untuk bereplikasi dalam sel neuron. Meskipun SB bereplikasi pada tingkat yang hampir 1000 kali lebih rendah daripada SN, dan penggantian TS, L, dan dalam SB oleh tingkat SN memiliki sedikit efek pada kinetika pertumbuhan virus, penggantian tambahan G atau G plus M dari SB oleh gen SN yang sesuai mengakibatkan peningkatan 1-log dalam produksi virus, yang menunjukkan bahwa kinetika replikasi RNA virus serta produksi partikel virus sebagian besar dikendalikan oleh protein G RV. Kesimpulan ini didukung oleh data yang diperoleh dengan varian G RV yang berbeda dengan satu asam amino dalam protein G mereka. Varian virus rabies patogenik SPBNGAK 194 menghasilkan titer virus dalam sel NA yang 1 log lebih rendah daripada yang dihasilkan oleh varian nonpatogenik SPBNGAN 194, dan analisis PCR waktu nyata menunjukkan bahwa laju transkripsi dan replikasi RNA virus dalam sel NA yang terinfeksi SPBNGAK adalah 5 dan 10 kali lipat lebih tinggi daripada dalam sel NA yang terinfeksi SPBNGAK.[ 52 ] Bukti lebih lanjut untuk korelasi terbalik antara patogenisitas dan laju sintesis RNA virus dan produksi partikel virus diberikan oleh tikus yang terinfeksi virus rekombinan kimerik di mana gen G dan M dari galur SN yang dilemahkan digantikan oleh gen galur SB yang sangat patogenik. Percobaan ini mengungkapkan peningkatan yang signifikan dalam patogenisitas galur SN parental yang membawa RV G di atas galur SB yang patogenik. Patogenisitas lebih jauh meningkat ketika G dan M dari SB dimasukkan ke dalam SN.
Substitusi G atau M atau keduanya dalam SN dengan gen yang sesuai dari SB dikaitkan dengan penurunan yang signifikan dalam laju produksi partikel virus serta laju sintesis RNA virus. Data ini menunjukkan bahwa baik G dan M memainkan peran penting dalam patogenesis RV dengan mengatur replikasi virus. Temuan bahwa substitusi G atau G ditambah M dalam SN dengan G atau G ditambah M dari SB menghasilkan penurunan sedang hingga kuat dalam transkripsi dan replikasi RNA virus, masing-masing, sementara substitusi M saja dalam SN dengan M dari SB menghasilkan peningkatan yang kuat dalam transkripsi dan replikasi RNA virus, menunjukkan bahwa RV G juga memiliki fungsi regulasi penting dalam transkripsi/replikasi RNA virus baik sendiri atau melalui interaksi dengan protein M. Mekanisme yang dengannya gen RV G mengendalikan sintesis RNA virus tidak diketahui. Urutan nukleotida tertentu dalam gen RV G, seperti yang mencakup kodon untuk Arg333 dan Lys 194, telah diidentifikasi sebagai target untuk miRNA seluler. Telah ditunjukkan bahwa pengenalan target oleh miRNA seluler dapat menghasilkan regulasi positif atau negatif terhadap replikasi virus. [ 53 ] Substitusi Arg 333 → Glu 333 atau Lys 194 → Ser 194 dalam urutan gen RV G menyebabkan penghapusan urutan target miRNA, yang pada gilirannya dikaitkan dengan peningkatan signifikan dalam laju sintesis RNA virus [Faber M, Thomas Jefferson University, PA, AS, Data Tidak Diterbitkan], yang menunjukkan bahwa miRNA seluler inang juga memainkan peran penting dalam regulasi replikasi RV, seperti yang telah ditunjukkan untuk virus RNA lainnya termasuk virus stomatitis vesikular dan HCV. [ 54 ], [ 55 ]
Pengaturan replikasi virus tampaknya menjadi salah satu mekanisme penting yang terlibat dalam patogenesis RV. Untuk menghindari respons imun dan menjaga integritas jaringan saraf, galur RV patogenik, tetapi bukan galur yang dilemahkan, dapat mengatur laju pertumbuhannya. Laju replikasi yang lebih rendah kemungkinan menguntungkan galur RV patogenik dengan menjaga struktur saraf yang digunakan virus ini untuk mencapai sistem saraf pusat. Penjelasan lain untuk laju replikasi RV patogenik yang lebih rendah adalah bahwa, untuk menghindari deteksi dini oleh sistem imun inang, virus mempertahankan tingkat ekspresi antigennya yang minimal.
Hubungan antara ekspresi RV G, apoptosis dan patogenisitas
Telah diketahui bahwa galur virus rabies jalanan yang secara signifikan lebih patogenik daripada galur yang beradaptasi dengan kultur jaringan mengekspresikan kadar G yang sangat terbatas dan tidak menginduksi apoptosis hingga akhir siklus infeksi, yang menunjukkan bahwa patogenisitas galur virus tertentu berkorelasi terbalik dengan ekspresi G RV dan kemampuan untuk menginduksi apoptosis.[ 56 ] Bukti langsung untuk korelasi antara tingkat ekspresi G dan tingkat apoptosis diperoleh dengan RV rekombinan SPBNGA-GA, yang membawa dua gen G yang identik dan mengekspresikan RV G secara berlebihan.[ 57 ] Studi morfologi kultur neuron yang terinfeksi dengan RV rekombinan ini menunjukkan bahwa kematian sel meningkat secara signifikan seiring dengan ekspresi berlebihan RV G dan bahwa apoptosis adalah mekanisme utama yang terlibat dalam kematian yang dimediasi RV G. Secara khusus, penurunan pewarnaan F-aktin setelah infeksi SPBNGA-GA konsisten dengan depolymerisasi filamen aktin yang diinduksi apoptosis. Lebih jauh lagi, jumlah nukleus TUNEL-positif pada neuron yang terinfeksi SPBNGA-GA meningkat secara signifikan dibandingkan dengan yang ada pada neuron yang tidak terinfeksi dan yang terinfeksi SPBNGA. Akan tetapi, mekanisme yang digunakan gen RV G untuk memediasi proses pensinyalan apoptosis masih belum diketahui secara luas. Telah dikemukakan bahwa ekspresi RV G di atas ambang tertentu sangat mengganggu membran sel. Sangat mungkin bahwa sel-sel apoptosis tidak dibersihkan dengan cepat di dalam SSP dan oleh karena itu mengalami nekrosis sekunder. [ 58 ] Di sisi lain, infeksi RV dan khususnya ekspresi berlebihan protein RV G dapat menyebabkan piroptosis, suatu jalur kematian sel yang mirip dengan apoptosis yang, tidak seperti apoptosis, melibatkan aktivasi caspase 1 dan dengan demikian menyebabkan nekrosis. [ 59 ] Derajat nekrosis atau piroptosis yang disebabkan oleh infeksi RV kemungkinan memainkan peran penting dalam induksi imunitas antivirus. Sementara sel-sel apoptosis mempertahankan integritas membrannya dan tidak menstimulasi respon imun bawaan, sel-sel nekrotik menjadi permeabil dan mengeluarkan adjuvan endogen yang dapat memicu respon imun bawaan yang kuat. [ 60 ]
Karena tingkat apoptosis/nekrosis berkorelasi dengan imunogenisitas RV, telah disarankan bahwa efek imunostimulasi dari sel-sel apoptotik/nekrotik kemungkinan besar berkontribusi pada pembentukan respons imun protektif. Oleh karena itu, regulasi ekspresi G RV kemungkinan besar merupakan faktor penting dalam patogenesis rabies, karena menyediakan sarana untuk kelangsungan hidup dan penyebaran varian RV patogenik dalam sistem saraf tanpa menyebabkan kerusakan saraf yang nyata dan menimbulkan respons imun protektif yang akan mencegah infeksi.
Ekspresi RV G dapat diatur pada tingkat sintesis RNA, tingkat pascatranslasi, atau keduanya. Tingkat RV G yang diekspresikan oleh varian chimeric RV yang berbeda telah terbukti tercermin oleh laju sintesis RNA virus, yang menunjukkan bahwa regulasi diferensial ekspresi RV G oleh varian ini dihasilkan dari variasi laju transkripsi mRNA virus. Seperti halnya laju transkripsi RNA virus, jumlah RV G yang diekspresikan oleh varian ini berkorelasi terbalik dengan patogenisitas virus. Di sisi lain, infeksi kultur neuronal primer dengan varian RV yang kurang patogenik CVS-B2c menghasilkan kadar protein G empat kali lipat lebih tinggi daripada infeksi dengan varian CVS-N2c yang sangat patogenik, meskipun sintesis kadar mRNA G yang sebanding pada kedua infeksi. Eksperimen pulse-chase menunjukkan bahwa kadar protein G yang lebih tinggi pada neuron yang terinfeksi CVS-B2c sebagian besar merupakan hasil dari laju degradasi protein G CVS-B2c yang lebih rendah dibandingkan dengan protein G CVS-N2c. Namun, mekanisme yang menyebabkan degradasi proteolitik protein G CVS-N2c yang lebih cepat masih harus dijelaskan.
Gejala rabies
Masa inkubasi rabies rata-rata 30-90 hari. Jika terjadi infeksi masif melalui luka besar di kepala dan wajah, masa inkubasi dapat dipersingkat menjadi 12 hari. Dalam kasus yang jarang terjadi, masa inkubasi dapat berlangsung selama 1 tahun atau lebih.
Ada perubahan berurutan yang ketat dari tiga periode penyakit: prodromal, eksitasi, kelumpuhan.
Periode prodromal dimulai dengan munculnya rasa sakit atau nyeri tarikan di tempat gigitan, serta nyeri di sepanjang saraf. Di area bekas luka, mungkin ada sensasi terbakar, gatal, terkadang kemerahan dan bengkak. Pasien mengalami malaise umum, sakit kepala, mual. Muntah, peningkatan suhu tubuh hingga 37,5-38 ° C dan gejala gangguan mental progresif dicatat: peningkatan rangsangan refleks, perasaan cemas yang tidak dapat dijelaskan, ketakutan, melankolis. Seringkali pasien tertekan, terhambat, menarik diri, menolak makan, kurang tidur, mengeluh pikiran suram, mimpi menakutkan. Periode prodromal berlangsung 2-3 hari, terkadang meluas hingga 7 hari. Pada akhir periode ini, mungkin ada serangan kecemasan dengan kesulitan bernapas jangka pendek, perasaan sesak di dada, disertai takikardia dan peningkatan laju pernapasan.
Periode kegembiraan ditandai dengan munculnya hidrofobia: ketika mencoba minum, dan kemudian saat melihat air atau mengingatnya, pasien mengalami kejang faring dan laring yang kejang, di mana ia membuang cangkir air sambil berteriak, melemparkan tangan gemetar ke depan, melemparkan kepala dan tubuhnya ke belakang. Leher terentang, seringai menyakitkan mendistorsi wajah, yang menjadi kebiru-biruan karena kejang otot-otot pernapasan. Mata melotot, mengekspresikan rasa takut, memohon bantuan, pupil melebar, menghirup sulit. Pada puncak serangan, henti jantung dan pernapasan mungkin terjadi. Serangan berlangsung selama beberapa detik, setelah itu kondisi pasien tampaknya membaik. Selanjutnya, serangan kejang otot-otot laring dan faring dapat terjadi bahkan dari pergerakan udara (aerophobia), cahaya terang (fotofobia) atau kata-kata keras (acousticophobia). Serangan disertai dengan agitasi psikomotorik, yang membuat pasien bertingkah seperti "orang gila". Kesadaran menjadi kabur selama serangan, tetapi membaik pada periode interiktal. Selama periode agitasi, karena peningkatan tonus sistem saraf simpatik, pasien mengalami peningkatan tajam dalam produksi air liur (sialorea) dengan ketidakmampuan menelan air liur karena kejang otot-otot faring. Pasien menyemprotkan air liur. Beberapa pasien mungkin mengalami tanda-tanda meningisme dan bahkan opistotonus, dan kejang sering terjadi. Dalam kasus ini, cairan serebrospinal mungkin tidak berubah, tetapi pada beberapa pasien, konsentrasi protein dapat meningkat dan jumlah sel dapat meningkat karena limfosit.
Tanpa penanganan yang memadai, tanda-tanda dehidrasi meningkat, fitur wajah menjadi lebih tajam, dan berat badan menurun. Suhu tubuh meningkat ke nilai yang tinggi. Kejang mungkin terjadi. Durasi tahap eksitasi sekitar 2-3 hari, jarang 4-5 hari. Kematian biasanya terjadi selama salah satu serangan. Jarang terjadi, pasien bertahan hidup hingga tahap ketiga penyakit.
Selama periode kelumpuhan, pasien menjadi tenang. Serangan hidrofobia berhenti, pasien dapat minum dan menelan makanan, kesadarannya jernih. Namun, meskipun tampak sehat, kelesuan, apatis, depresi meningkat, kelumpuhan anggota badan, gangguan panggul, kelumpuhan saraf kranial segera muncul. Suhu tubuh naik hingga 42-43 °C, tekanan arteri turun, dan pada akhir hari pertama kematian terjadi karena kelumpuhan pusat kardiovaskular dan pernapasan.
Leukositosis neutrofilik, peningkatan hemoglobin, eritrosit, dan hematokrit diamati dalam darah tepi.
Apa yang mengganggumu?
Formulir
Secara klinis, dibedakan bentuk tipikal dan atipikal. Bentuk atipikal mencakup semua kasus tanpa gairah dan hidrofobia. Bentuk atipikal meliputi bulbar, serebelum, meningoensefalitis, dll.
Diagnostik rabies
Deteksi antigen rabies, antibodi, RNA virus, atau isolasi virus memungkinkan diagnosis rabies. Karena setiap tes individual mungkin negatif pada pasien rabies, sampel serum serial untuk deteksi antibodi rabies, sampel air liur untuk kultur virus, dan biopsi kulit untuk pengujian imunofluoresensi langsung untuk antigen virus terkadang diperlukan, terutama jika rabies sangat dicurigai.
Salah satu metode tercepat untuk mendiagnosis rabies antemortem pada manusia adalah dengan melakukan uji imunofluoresensi langsung pada biopsi kulit di tengkuk untuk mendeteksi antigen rabies. Uji imunofluoresensi langsung adalah metode yang paling sensitif dan spesifik untuk mendeteksi antigen rabies pada kulit dan jaringan segar lainnya (misalnya, biopsi otak), meskipun hasilnya terkadang negatif pada awal penyakit. Jika jaringan segar tidak tersedia, pencernaan enzimatik jaringan tetap dapat meningkatkan reaktivitas uji imunofluoresensi; namun, sensitivitasnya mungkin terlalu rendah.
Diagnosis juga dapat ditegakkan jika virus diisolasi dari air liur setelah inokulasi sel neuroblastoma atau tikus laboratorium; ini biasanya paling efektif selama 2–3 minggu pertama penyakit. Deteksi antibodi penetral virus rabies, biasanya dilakukan dengan uji penghambatan fokus fluoresensi cepat (RFFIT), dalam serum individu yang tidak divaksinasi juga merupakan diagnostik. Kehadiran antibodi dalam cairan serebrospinal mengonfirmasi diagnosis, tetapi antibodi tersebut mungkin muncul 2–3 hari lebih lambat daripada antibodi serum dan oleh karena itu mungkin kurang berguna pada tahap awal penyakit. Sementara respons serologis setelah vaksinasi umumnya tidak dapat dibedakan dari respons serologis yang disebabkan oleh penyakit, vaksinasi biasanya tidak menghasilkan antibodi terhadap cairan serebrospinal.
Hanya tujuh kasus "pemulihan" rabies dalam 25 tahun terakhir yang terdokumentasi dengan baik. Meskipun virus rabies tidak diisolasi dari pasien mana pun, titer antibodi penetral rabies yang tinggi dalam sampel serum dan keberadaan antibodi penetral dalam cairan serebrospinal sangat mendukung diagnosis tersebut.
Apa yang perlu diperiksa?
Tes apa yang dibutuhkan?
Perbedaan diagnosa
Diagnosis rabies pada manusia biasanya dibuat berdasarkan data epidemiologi dan klinis serta dikonfirmasi di laboratorium. Diagnosis mudah dilakukan jika ada riwayat gigitan hewan dan spektrum penuh gejala dan tanda telah terjadi. Jika tidak, evaluasi yang cermat namun cepat terhadap ciri epidemiologi dan klinis dari kasus yang kurang umum diperlukan sebelum melakukan uji laboratorium khusus. Setiap pasien dengan tanda atau gejala neurologis atau ensefalitis yang tidak dapat dijelaskan harus ditanyai tentang kemungkinan terpapar hewan di daerah endemis rabies di dalam atau di luar negara tempat tinggal. Kegagalan untuk mencurigai rabies pada beberapa kematian manusia baru-baru ini di Amerika Serikat mungkin disebabkan oleh kurangnya riwayat paparan yang cermat.
Pada awal penyakit, rabies dapat menyerupai banyak penyakit menular dan tidak menular. Banyak ensefalitis lain, seperti yang disebabkan oleh virus herpes dan arbovirus, menyerupai rabies. Penyakit menular lain juga dapat menyerupai rabies, seperti tetanus, malaria serebral, rickettsiosis, dan demam tifoid. Penyakit menular paralitik yang dapat disamakan dengan rabies meliputi poliomielitis, botulisme, dan ensefalitis herpes simian B.
Penyakit tidak menular yang dapat disalahartikan sebagai rabies meliputi sejumlah sindrom neurologis, terutama polineuropati inflamasi akut (sindrom Guillain-Barré), serta ensefalomielitis pasca-vaksinasi alergi yang disebabkan oleh vaksinasi rabies pada jaringan saraf, keracunan atau intoksikasi obat, putus alkohol, porfiria akut, dan histeria rabies. Sindrom Guillain-Barré dapat disalahartikan sebagai rabies paralitik, dan sebaliknya.
Siapa yang harus dihubungi?
Pengobatan rabies
Pengobatan untuk rabies belum dikembangkan. Pemberian imunoglobulin antirabies dan interferon leukosit dosis besar tidak efektif. Pengobatan simptomatik diberikan untuk meringankan penderitaan pasien. Untuk tujuan ini, pasien ditempatkan di bangsal atau kotak terpisah, dibuat aturan perlindungan yang membatasi pengaruh lingkungan eksternal (mengurangi kebisingan, cahaya terang, aliran udara). Untuk mengurangi rangsangan sistem saraf pusat, pil tidur, antikonvulsan, dan penghilang rasa sakit diresepkan. Keseimbangan air dinormalisasi.
Pada tahap paralitik, obat-obatan diresepkan yang merangsang aktivitas sistem kardiovaskular dan pernapasan. Dianjurkan untuk menggunakan oksigenasi hiperbarik, hipotermia serebral, pernapasan mekanis terkontrol dengan kurarisasi lengkap pasien. Namun, semua metode pengobatan praktis tidak efektif. Dalam kasus terbaik, adalah mungkin untuk memperpanjang hidup pasien selama beberapa bulan. Hasil yang tidak menguntungkan ditentukan sebelumnya oleh tingkat keparahan kerusakan batang otak dengan penghancuran pusat-pusat vital.
Pencegahan
Pengembangan vaksin rabies pertama oleh Pasteur pada tahun 1885 menandai dimulainya era pengendalian rabies yang jauh lebih efektif. Saat ini, meskipun tingkat kematian manusia akibat rabies hampir 100%, penyakit ini sepenuhnya dapat dicegah melalui vaksinasi pra dan/atau pasca pajanan. Sementara Pasteur dan rekan-rekannya memprakarsai vaksinasi anjing pribadi di Paris, vaksinasi massal pertama terhadap anjing dilakukan pada awal tahun 1920-an di Jepang, yang menandai program pengendalian rabies nasional besar pertama. Vaksinasi oral terhadap hewan liar, yang pertama kali dikembangkan pada tahun 1970-an, sejak saat itu telah berulang kali terbukti efektif mengendalikan penyakit pada inang darat utama seperti rubah, rakun, dan sigung.[ 68 ] Vaksinasi rabies berkelanjutan terhadap populasi hewan reservoir pada tingkat cakupan 70% atau lebih tinggi pada akhirnya akan menghilangkan RABV dari spesies reservoir dan mencegah penyebaran virus ke inang insidental. [ 69 ]
Data filogenetik menunjukkan bahwa lissavirus menginfeksi kelelawar jauh sebelum menginfeksi mamalia darat, dan sebagian besar lissavirus, termasuk RABV, masih beredar di berbagai spesies kelelawar di seluruh dunia.[ 70 ] Namun, metode yang efektif untuk mencegah penularan RABV di antara kelelawar masih sulit dipahami, sehingga menghalangi kemungkinan pemberantasan rabies secara menyeluruh saat ini. Namun, bahkan setelah terpapar RABV melalui gigitan mamalia yang terinfeksi rabies, profilaksis pasca pajanan yang aman dan efektif (PEP, termasuk pembersihan luka, imunoglobulin rabies, dan vaksinasi rabies) dapat melindungi manusia dari infeksi rabies jika pengobatan diberikan segera dan sesuai dengan rekomendasi Organisasi Kesehatan Dunia (WHO).
Kedua metode pencegahan kematian manusia ini—satu berdasarkan vaksinasi orang yang terpapar dan yang lainnya berdasarkan vaksinasi anjing yang cukup untuk memutus siklus penularan di sumbernya—merupakan dasar pendekatan "satu kesehatan" untuk pencegahan dan pengendalian rabies pada anjing. Kedua cara pencegahan kematian manusia yang berbeda ini dianggap sebagai alternatif terpisah: Strategi A, berdasarkan pemberian PEP kepada manusia, dan Strategi B, berdasarkan vaksinasi anjing; atau sebagai komponen gabungan Strategi A + B dalam analisis kemungkinan biaya dari strategi alternatif.[ 71 ]
Negara-negara seperti Thailand telah sangat sukses dalam mencegah kematian manusia melalui penggunaan PEP, tetapi juga menemukan adanya peningkatan permintaan dan biaya terkait dengan penggunaan PEP saja. [ 72 ] Misalnya, dibandingkan dengan situasi pada tahun 1991, empat kali lebih banyak orang (lebih dari 400.000) membutuhkan PEP pada tahun 2003. Data terbaru menunjukkan bahwa Republik Rakyat Tiongkok, yang memvaksinasi 15 juta orang per tahun setelah potensi paparan rabies, menghabiskan sekitar US$650 juta per tahun hanya untuk PEP. [ 73 ]
Pendekatan yang jauh lebih berkelanjutan adalah mencegah penyebaran infeksi pada sumbernya, pada populasi hewan, sambil meningkatkan akses ke PEP bagi pasien manusia yang terpapar bila diperlukan. Jika ada kemauan politik dan pendanaan yang memadai untuk mengendalikan rabies anjing, kematian dapat dan telah dihilangkan. Penggunaan vaksinasi anjing secara luas telah menyebabkan eliminasi rabies anjing dari beberapa negara, termasuk Malaysia pada tahun 1954, [ 74 ] Jepang pada tahun 1956, Taiwan pada tahun 1961, Singapura, dan khususnya di seluruh Eropa Barat (diulas dalam Rupprecht et al, King et al, dan Gongal dan Wright). [ 75 ]


 [
[